A reakcja endotermiczna wymaga energii, podczas gdy reakcja egzotermiczna Ta klasyfikacja reakcji chemicznych uwzględnia udział energii albo jako reaktora, albo jako produktu.
Energia to zdolność do wykonywania pracy lub wytwarzania ciepła. Przypomnijmy, że reakcje chemiczne polegają na zmianie układu atomów między substancjami z przerwaniem lub utworzeniem wiązań chemicznych. Zazwyczaj temu tworzeniu lub przerwaniu wiązań chemicznych towarzyszą zmiany energii układu.
| Reakcja endotermiczna | Reakcja egzotermiczna | |
|---|---|---|
| Definicja | Reakcja chemiczna, w której pochłaniana jest energia. | Reakcja chemiczna, w której energia uwalniana jest w postaci ciepła. |
| Źródło energii | Ze środowiska | Z systemu |
| Energia potencjalna | Niższa w reaktorach niż w produktach. | Wyższa w reaktorach niż w produktach. |
| Produkcja | Niespontaniczne | Spontaniczna |
| Zmiana energii wewnętrznej | ΔE>0; zmiana energii wewnętrznej większa od zera. | ΔE<0; zmiana energii wewnętrznej mniejsza od zera. |
| Temperatura | Zmniejszenie | Zwiększenie |
| Przykłady | Reakcje w fotosyntezie i syntezie w ogóle. | Płonąca zapałka, reakcje spalania. |
Co to jest reakcja endotermiczna?
Reakcja chemiczna jest endotermiczna, gdy absorbuje energię z otoczenia W tym przypadku ciepło jest przekazywane z zewnątrz do wewnątrz układu. Po umieszczeniu termometru w czasie trwania reakcji endotermicznej, temperatura maleje.
Słowo "endotermiczny" pochodzi z języka greckiego endon oznaczające "wewnątrz" oraz therme Reakcje endotermiczne nie przebiegają samorzutnie.
Skąd bierze się energia w reakcjach endotermicznych?
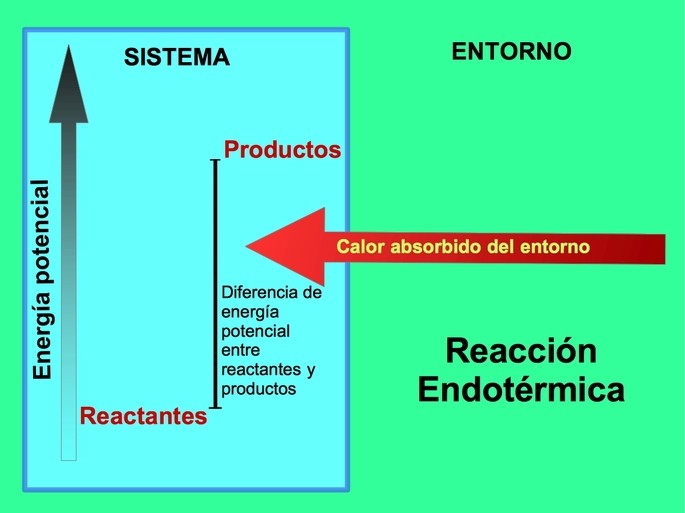
Wykres energetyczny ogólnej reakcji endotermicznej.
W reakcjach endotermicznych energia pochodzi z otoczenia poza układem.Ilość energii potencjalnej produktów jest większa niż energia potencjalna reagentów.Dlatego aby reakcja przebiegała, do reagentów musi być dodana energia.Energia ta pochodzi z ciepła otoczenia.
Na przykład, fotosynteza jest procesem endotermicznym gdzie rośliny przechwytują energię słoneczną, aby wyprodukować glukozę z dwutlenku węgla i tlenu:
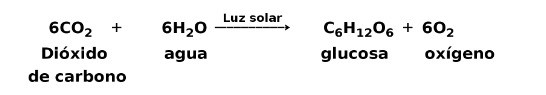
Produkty reakcji fotosyntezy, glukoza i tlen, mają więcej energii potencjalnej niż reagenci, dwutlenek węgla i woda. Inne przykłady endotermicznych reakcji chemicznych z podaniem ilości zużytej energii:

Przykłady reakcji endotermicznych
Nie tylko w laboratorium chemicznym zachodzą reakcje, ale także w życiu codziennym, gdzie występują reakcje endotermiczne.
Gotowanie żywności
Choć może się to nie wydawać, proces gotowania żywności jest endotermiczny. Aby spożywać niektóre pokarmy, musimy dostarczyć ciepło.
Natychmiastowy zimny okład
Zimne okłady stosowane w leczeniu stłuczeń lub zwichnięć są wypełnione wodą, ale gdy się nimi potrząsa lub puka, w środku pęka kapsułka zawierająca azotan amonu. Zmieszanie azotanu amonu z wodą to reakcja endotermiczna, która powoduje schłodzenie okładu.
Może Cię zainteresować Różnica między ciepłem a temperaturą.
Co to jest reakcja egzotermiczna?
A Reakcja egzotermiczna to taka, w której energia wypływa z układu. Energia ta uwalniana jest w postaci ciepła, więc po umieszczeniu termometru w układzie reakcyjnym temperatura wzrasta.
Słowo "egzotermiczny" składa się z następujących wyrazów exo oznaczające "na zewnątrz" oraz termy, Reakcje egzotermiczne mogą zachodzić samorzutnie, a w niektórych przypadkach być wybuchowe, jak np. połączenie metali alkalicznych z wodą.
Skąd bierze się energia w reakcjach egzotermicznych?
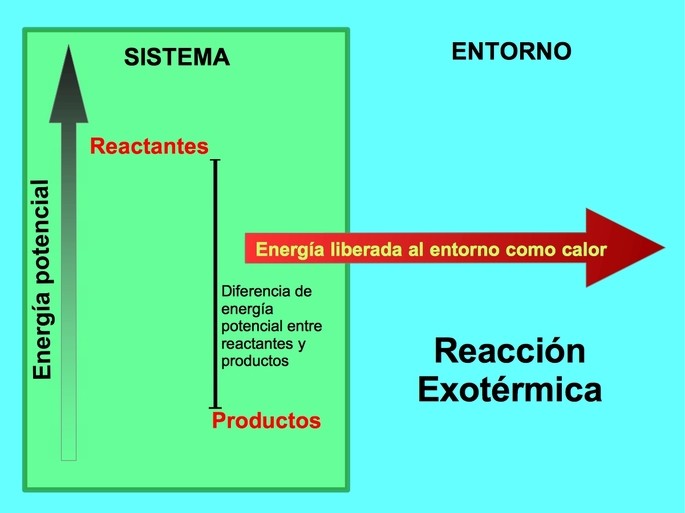
Wykres energetyczny ogólnej reakcji egzotermicznej.
W reakcji chemicznej reagentami są związki, które ulegają przemianie i dają produkty. Na przykład, gdy sód Na reaguje z chlorem Cl, to są to reagenty, a produktem jest chlorek sodu NaCl:
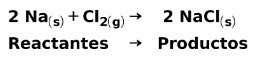
Zarówno reagenty jak i produkty mają zgromadzoną energię potencjalną.Wiemy z l e zachowania energii że energii nie można ani stracić, ani zyskać, więc energia reagentów musi być równa energii produktów.
W reakcji egzotermicznej, l reaktory mają większą energię potencjalną w porównaniu do produktów. W tym przypadku energia jest również traktowana jako część produktów:

W każdym procesie egzotermicznym część energii potencjalnej zgromadzonej w wiązaniach chemicznych jest zamieniana na energię cieplną za pośrednictwem ciepła.
Przykłady reakcji egzotermicznych
Środek piorący
Kiedy rozpuszczamy w wodzie na dłoni odrobinę proszku do prania, możemy poczuć lekkie ocieplenie.
Spalanie gazu w gospodarstwach domowych
Spalanie gazów do użytku domowego, takich jak metan czy butan, polega na reakcji chemicznej z tlenem z utworzeniem dwutlenku węgla i wody oraz uwolnieniem energii. Jest to typowa reakcja egzotermiczna w codziennym użyciu:
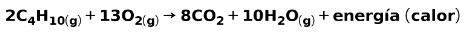
Energia uwolniona w procesie spalania jest wykorzystywana do gotowania potraw.
Może zainteresuje Cię również informacja, czym jest system otwarty, system zamknięty i system izolowany.